云分享

分享主题:溶解度和溶度积
分享人:19创新班谢瑶瑶
审核人:时茜老师
1.溶解度
在一定温度下,达到溶解平衡时,一定量的溶剂中含有溶质的质量,叫做溶解度,通常以符号S表示。
对水溶液来说,通常以饱和溶液中每100克水所含溶质质量来表示,即以:g/100g水表示。
2.溶度积
在一定温度下,将难溶解电解质晶体放入水中时,就发生溶解和沉淀两个过程。
如:BaSO4⇆Ba2++SO42- ,
一般沉淀反应:AnBm(s)⇆nAm++mBn-(aq)
溶度积常数,简称溶度积。Kspθ(AnBm)={c(Am+)}n{c(Bn-)}m
沉淀溶解平衡是一种化学平衡;Kspθ是一种化学平衡常数
3.溶解度和沉淀积
溶解度和溶度积的相互换算
AnBm(s)⇆nAm++mBn-(aq)
nS mS
Kspθ=[nS]n[mS]m
AB型 S=√Kspθ
在有关溶度积的计算中,离子浓度必须是物质的量浓度,其单位时mol·L-1,而溶解单位往往是g/100g。因此,计算时有时要先将难溶电解质的溶解度S的单位换算成mol·L-1。本章溶解度的单位均用mol·L-1
就是要清楚溶度积和溶解度的关系。
溶解度和溶度积都能表示一个物质溶解的程度,但是不能简单的理解,溶解度越大,溶度积越大。
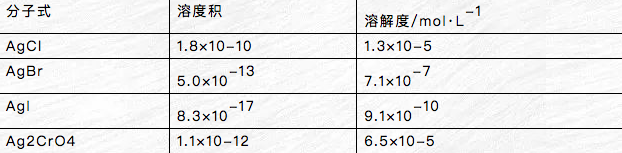
相同类型的难溶电解质,其Kspθ大的S也大。不用类型的难溶电解质不能直接用溶度积比较器=其溶解度的相对大小。
Kspθ(AgCl)>Kspθ(Ag2CrO4) S(AgCl)>S(Ag2CrO4)
化学平衡中,我们学过反应商判断依据。其实沉淀-溶解平衡中也有反应商判据,即溶度积规则。
溶度积规则:
BaSO4⇆Ba2++SO42-
J=[Ba2+]×[SO42- ]
根据平衡移动原理,将J和Kspθ比较
J>Kspθ 平衡向左移动——沉淀析出
J=Kspθ 处于平衡状态——饱和溶液
J<Kspθ 平衡向右移动——无沉淀或沉淀溶解
其实这里特别要注意的是,当离子积等于溶度积的这样一个关系。可以理解成饱和溶液,也可以理解成,刚刚开始沉淀,或者刚开始溶解时的状态。一种临界值的状态。
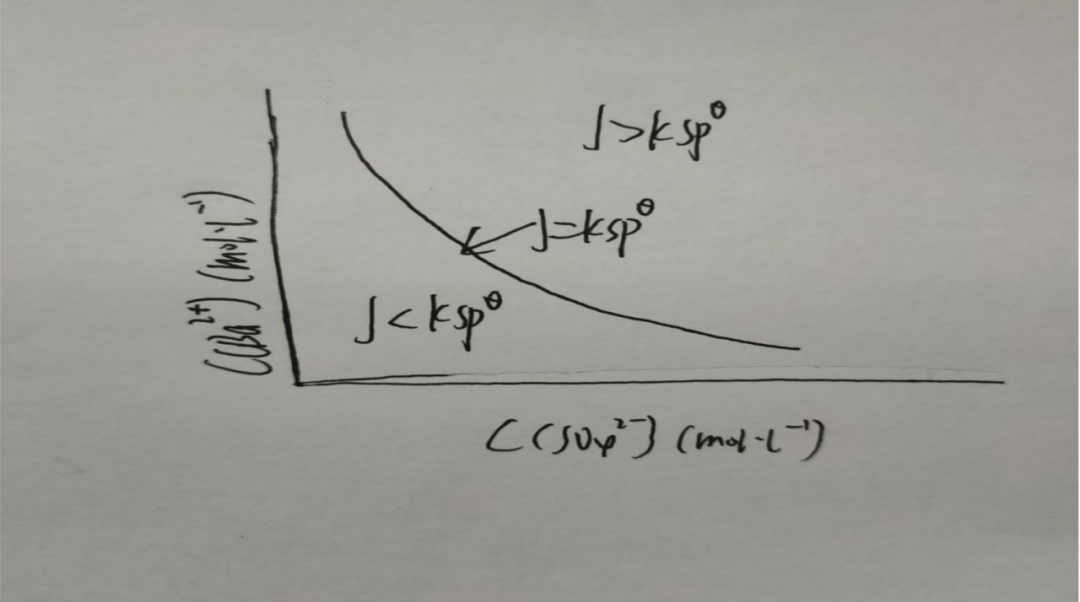
溶度积规则反应在图中
曲线代表的是饱和溶液,曲线上方代表饱和溶液(有晶体或沉淀析出),曲线下方就是不饱和溶液(没有晶体或沉淀)。我们在之前学习过平衡移动,同样的离子浓度的改变也会导致平衡移动,直接的结果就是产生沉淀,或者让沉淀溶解。或者换句话说溶度积规则,就是沉淀-溶解平衡中的溶度积规则。
例如:BaCO3⇆Ba2++SO42-
①加酸 2H++CO2-3→H2O+CO2
c(CO2-3)↓
J↓
J<Kspθ 利于BaCO3的溶解
②加BaCl2或Na2CO3
C(Ba2+)↑或c(CO2-3)↑
J↑
J>Kspθ 促使BaCO3的生成
判断有没有沉淀生成,其实就是比较离子积与溶度积的关系。
例:Na2SO4溶液中加入BaCl2溶液,混合后c(SO42-)为6.0×10-4mol·l-1,c(Ba2+)为2.0×10-4mol·l-1,已知BaSO4的Kspθ =1.1×10-10,判断有无沉淀生成?
J=c(SO42-)·c(Ba2+)
=(6.0×10-4)×(2.0×10-4)=1.2×10-7
K>Kspθ ,因此有沉淀产生
在难溶的强电解质溶液中,加入含有相同离子的强电解质时,难溶电解质的溶解度减小,这一作用称为同离子效应。
一定要理解同离子效应存在时,溶解度的计算
盐效应:
在难溶电解质溶液中,加入易溶强电解质而使难溶电解质的溶解度增大的作用。
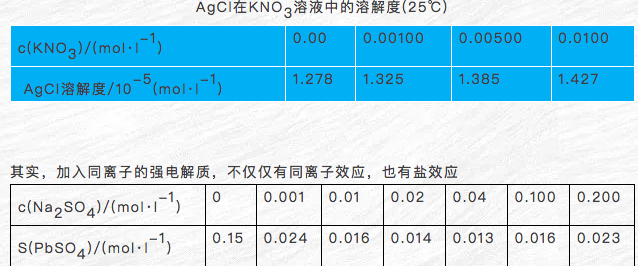
①当c0(SO42-)<0.04mol·l-1时,c(SO42-)增大,S(PbSO4)显著减小,同离子效应占主导
②当c0(SO42-)>0.04mol·l-1时,c(SO42-)增大,S(PbSO4)缓慢增大,盐效应占主导
能否认为沉淀剂过量越多,沉淀越完全呢?
答:如果沉淀剂过量越多,以盐效应为主,就会增大溶解度。因此,在合适的范围内,沉淀剂过量,沉淀趋于完全。
也就是,较低浓度时,以同离子效应为主,较高浓度时,以盐效应为主。