作者:Zhu-Zhu Zhang; Jia-Jia Lei; Xiao-Hong Zhang; Xing-Guo Zhang and Hai-Yong Tu.
论文题目:Ni-Catalyzed Reductive Fluoroalkylacylation of Alkynes for the Steroselective Synthesis of Fluoroalkylated Enones.
DOI:10.1021/acs.orglett.2c02464
https://doi.org/10.1021/acs.orglett.2c02464

由于氟原子的独特性质,含氟有机化合物广泛应用于农药、医药和材料化学等领域[1]。将氟原子或含氟基团引入有机分子能显著提高分子的亲脂性以及增强其代谢稳定性。近几十年来,芳香化合物的氟烷基化反应已经取得了重大进展,但制备氟烷基化烯烃的有效方法仍未得到充分探索。最近,硕士研究生张珠珠等人在张兴国教授、张小红副教授和涂海勇副教授的指导下发展了一种快速高效的合成氟烷基化烯烃的新方法。该方法研究了在Ni催化剂下,炔烃与氟代烷基卤化物和酰氯的三组分还原氟代烷基化酰基化反应。这种双碳官能化反应具有高产率和优异的区域选择性和立体选择性等优点。相关结果发表在Organic Letters。
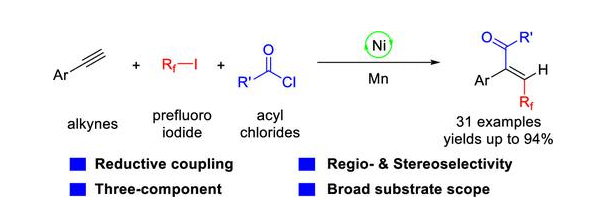
首先,作者选择苯乙炔、全氟碘代丁烷和苯甲酰氯反应作为模板反应,对反应条件进行了探究。结果表明,碘化镍为催化剂,1,10-菲啰啉为配体,锰粉为还原剂,三甲基氯硅烷为添加剂,超干乙二醇二甲醚为溶剂,在氮气氛围下于室温反应6小时,获得了最高收率为92%。随后,作者在最优条件下对反应的官能团耐受性进行了考察。苯乙炔上无论引入供电子基团或是吸电子基团时,反应仍保持中等至优良的收率;令人高兴的是杂环炔也是合适的底物,同时不对称内炔也可以获得中等的收率;然而脂肪族炔烃在这种镍催化的还原转化中是无效的。芳环上带有供电子基团或是吸电子基团的酰氯进行反应仍保持优良的收率,同时多环芳烃和杂环酰氯也是合适的底物;值得注意的是,脂肪族酰氯如新戊酰氯也成功地转化为烯酮。最后探讨了全氟烷基碘化物的范围,各种氟烷基化烯酮均以高收率获得。此外,获得的氟烷基化烯酮可以进一步转化为一系列含氟烷基的基序,将用于医药和农用化学品领域。
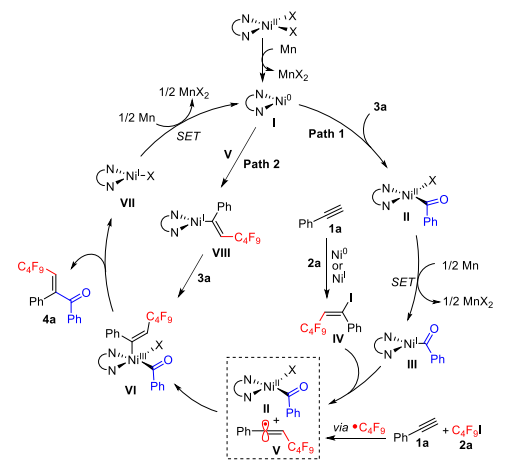
根据以上实验结果,作者提出了一种可能的机理:首先,将酰氯3a氧化加成到通过Mn还原原位生成的Ni(0)物种I,得到(酰基)Ni(II)-X物种II,然后在Mn存在下进行单电子还原生成(酰基)Ni(I)中间体III。同时,Ni(0)或Ni(I)物质介导C4F9I与炔烃的自由基加成和随后的碘原子转移,得到E-烯基碘化物IV。随后,中间体III和中间体IV之间的单电子转移提供(酰基)Ni(II)物种II和烯基自由基V。或者,发生全氟烷基自由基与炔烃的自由基加成,然后拦截Ni(II)物种II得到Ni(III)物种VI。最后,中间体VI参与还原消除生成产物4a和Ni(I)物种VII,后者被Mn还原为Ni(0)(路径1)。然而,乙烯基镍物种VIII与酰氯的直接氧化加成的途径也是可能的(途径2)。